1. 르샤틀리에 원리
Le Chatelier's principle
화학평형 상태에 있는 물질의 외부 조건을 변화시켰을때, 그 변화의 반대방향으로 평형이 움직인다.
쉽게 말하면, 압력, 온도, 조성, 부피 등이 변화할때 화학평형은 변화를 가능한 상쇄시키려는 방향으로 평형을 형성한다 라고 이해하면 된다.
뉴턴의 운동법칙 중 제1법칙인, 관성의 법칙과 유사하다고 할 수 있다. (본래의 상태를 유지하려고 하는 점이 비슷합니다.)
*정확히는 르 샤틀리에의 원리
2. 르샤틀리에 원리 - 예시
1) 농도의 변화
$CO + 2H_2 \rightleftharpoons CH_{3}OH$, 메탄올 생성반응
일산화탄소와 수소가 반응해서 메탄올이 형성되는 반응을 예시로 들어보자.
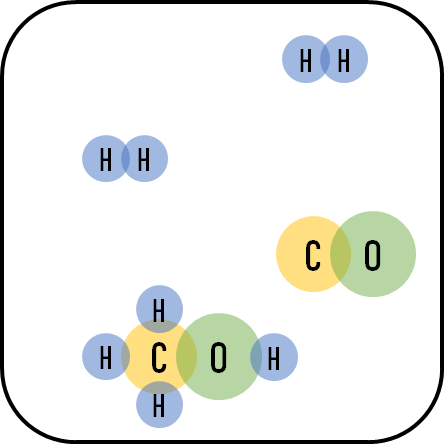
위 그림처럼 수소, 일산화탄소, 메탄올이 닫힌 용기에 담겨있고, 화학평형상태라 가정하자.
$CO$(일산화탄소)의 농도가 증가하게 된다면, 르샤틀리에 원리에 따라 일산화탄소의 농도를 줄이는 경향으로 평형이 움직이게 된다. 즉, 정반응을 진행시켜 메탄올을 더 많이 생성하게 된다.
2) 온도의 변화
$N_2 + 3H_2 \rightleftharpoons 2NH_3$, 암모니아 생성반응
위 반응은 발열 반응으로, 주위(surround)의 온도를 높인다.

위 용기의 온도를 낮춘다고 가정해보자. 그러면 르샤틀리에 원리에 따라 온도를 유지하려는(높이려는) 경향으로 평형이 움직이게 된다. 즉, 르샤틀리에 원리에 따라 온도를 낮추지 않기 위해 흡열반응인 역반응이 더욱 활발하게 진행된다. 즉, 암모니아$(NH_3)$ 를 덜 생성하게 된다.
반대로 온도를 낮추게 된다면, 정반응이 진행되어 암모니아의 수가 늘어나게 된다. (흡열반응의 역반응은 발열반응)
3) 압력의 변화
$N_2 + 3H_2 \rightleftharpoons 2NH_3$
압력은 기체 분자수에 비례한다. 기체 분자 수가 많아질수록 압력은 증가한다.

위 그림처럼 수소, 질소, 암모니아로 채워진 닫힌 용기가 있다고 가정해보자. 위 용기의 압력을 높여주면, 르샤틀리에 원리에 따라 압력을 낮추는 경향으로 평형이 움직일 것이다. 압력을 높이면 아래그림처럼 될 것이다.
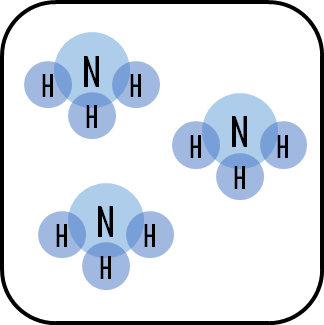
그림3에서는 분자개수가 6개이고, 그림4에서는 분자개수가 3개이다. 즉, 분자수가 6개일때 그림3의 용기 크기에 해당하는 압력과 분자수가 3개일때 그림4의 용기크기에 해당하는 압력이 동일하게 된다. (용기의 크기가 줄어든 것을 표현하기 위해 네모박스의 크기를 줄였다.)
3. 르샤틀리에 원리 - 활용
르샤틀리에 원리를 이용해 여러가지 화학물질을 보다 쉽게 만들어 낼 수 있었다. 특히 위에서 소개한 암모니아 생성반응으로 전세계 식량난을 극복한 수 있었던 사례가 있다.
$N_2 + 3H_2 \rightleftharpoons 2NH_3$ 바로 이 반응이다.
'자격증' 카테고리의 다른 글
| 위험물산업기사 2002년 1회 46,47,48,49,50번 풀이 (0) | 2021.06.10 |
|---|---|
| 위험물산업기사 2002년 1회 41,42,43,44,45번 풀이 (0) | 2021.06.09 |
| 위험물산업기사 2002년 1회 36,37,38,39,40번 풀이 (0) | 2021.06.08 |
| 압력단위환산 문제 푸는 법 (0) | 2021.06.07 |
| 위험물산업기사 2002년 1회 31,32,33,34,35번 풀이 (0) | 2021.06.07 |

댓글